Viaggio al centro del tutto
Atomi e molecole (2a parte)
La volta scorsa vi ho lasciati comodamente seduto sul nucleo di un atomo di idrogeno (H). Ho resistito alla tentazione di scendere alle dimensioni sottostanti per conoscere le particelle subatomiche, decidendo di concedere qualche momento di relax a me ed al mio accompagnatore virtuale. Risalire, pertanto, ai livelli superiori e precisamente al piano -10, per incontrare e conoscere meglio molecole ed atomi. Si! Ma come risalire cinque piani?
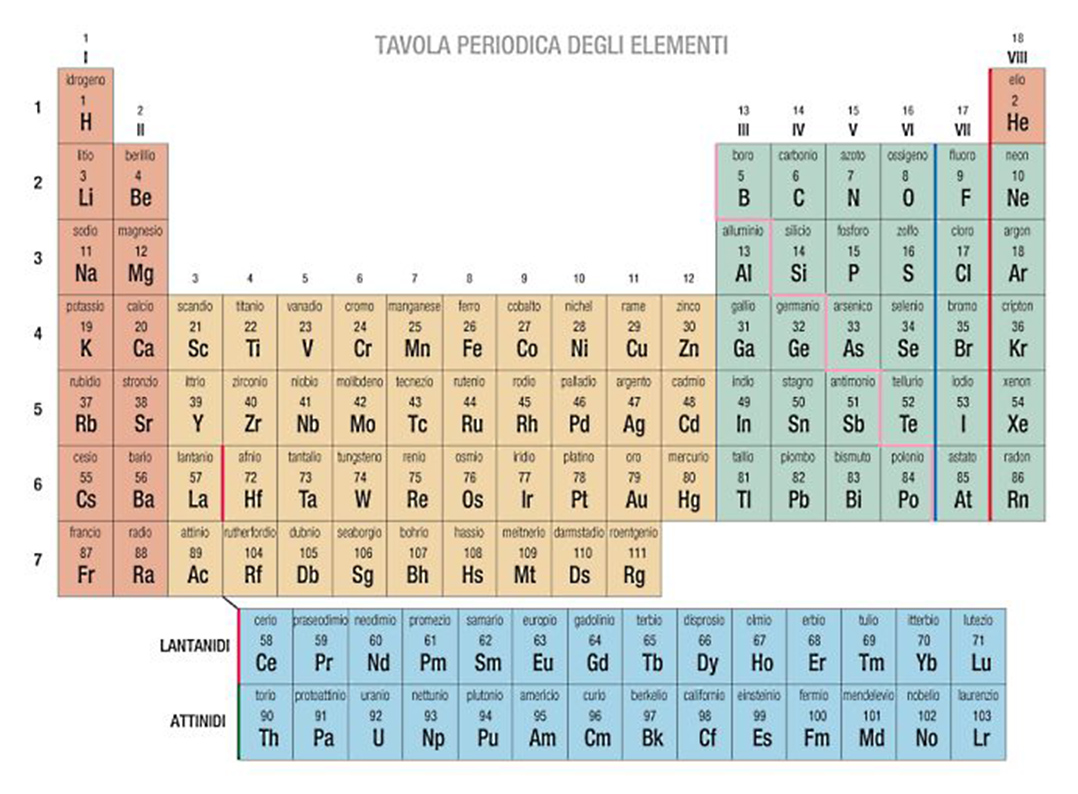
In alto vedo l’elettrone ruotare solitario sulla volta superiore dell’atomo di idrogeno. Mi ricordo, in questo preciso istante, che l’idrogeno è il primo atomo della tavola periodica degli elementi, una tabella ideata nel 1969 dal geniale chimico russo Dmitrij Ivanovič Mendeleev. Tabella che elenca ordinatamente tutti gli elementi conosciuti in natura. L’idrogeno, in alto a sinistra della tavola, ha numero atomico 1.
Questo significa che è composto da un nucleo centrale fatto di una sola particella di carica positiva: il protone, (su cui siedo in questo momento), nello spazio circostante orbita, solitario, un elettrone, 1000 volte più piccolo e di carica elettrica negativa ed attratto verso il nucleo (per la legge di Coulomb le cariche opposte si attraggono). è grazie alla sua enorme velocità e dalla sua energia quantica che rimane in equilibrio sulla sua orbita evitando di schiantarsi a “terra”.
I puristi della fisica quantistica, non inorridiscano per questa esposizione molto semplificata il cui solo scopo è quello di rendere l’idea dei meccanismi in gioco. A queste dimensioni le leggi della fisica classica perdono significato e questi fenomeni possono essere descritti solo facendo ricorso alla teoria dei quanti.
A queste profondità una cosa risalta su tutto: il vuoto enorme tra nucleo ed elettrone pari a circa 10.000 volte il diametro dello stesso nucleo. Come dire una mela al centro ed i suoi semi a ruotare alla distanza di un chilometro. In mezzo? niente, il vuoto!
Il che significa che la materia, anche la più dura, la più compatta, fondamentalmente è composta di nulla.
Se non ci fossero di mezzo le forze (non solo quelle elettriche) due barre di acciaio durissimo. se sovrapposte, si fonderebbero tra loro. Potremo tranquillamente attraversare una parete di cemento compatto, con gli atomi di cui siamo composti a penetrare quelli del calcestruzzo.
Divagazioni a parte, ora mi trovo nella condizione di “uscire” dall’idrogeno. Devo trovare il modo di attirare l’attenzione dell’elettrone, farlo scendere, salirvi in groppa e dirigermi ai confini dell’atomo sull’orbita esterna.
Provo ad ammiccare per attirare la sua attenzione. Niente, continua imperterrito il suo giro in giostra, ignorandomi. Mi viene un’idea, comincio a saltare battendo i piedi per scuotere il protone sotto di me. Le vibrazioni dello stesso, carico elettricamente, si propagano all’elettrone.
Dapprima rimane impassibile, poi con uno scatto d’ira, diminuisce la propria energia, rallenta, e si lascia risucchiare verso il centro di rotazione. Lo vedo scendere come una barca alla deriva verso di me, lo sento ansimare e la sua velocità diminuisce, approfitto di questo momento per fare un balzo a cavallo della particella.
Appena a bordo lo sento riprendere e risalire in alto, sulla sua orbita naturale, alla velocità della luce. In un battibaleno siamo ai confini dell’atomo di idrogeno, mi infilo nel primo varco ed eccomi fuori. Sono di nuovo a cavalcioni della molecola d’acqua. Mi asciugo il sudore e mi appresto a scendere.
Sono emozionatissimo, conscio che a quelle profondità nessuno poteva vederci, i più potenti microscopi elettronici sono in grado di “osservare” fino alla profondità di 10-9 – 10-10 metri e distinguere atomi e molecole. I normali microscopi ottici, invece, si fermano molto prima a livello cellulare 10-6 metri (almeno tre piani sopra, a grandezze mille volte maggiori).
Con un balzo scendo nell’affollato piano atomico-molecolare per conoscere alcuni frequentatori di questo livello.
Delle molecole d’acqua, abbiamo già fatto la conoscenza, mi guardo in giro, nella confusione mi pare di riconoscere una fisionomia nota. Mi avvicino e vedo due atomi stretti in un abbraccio come due innamorati inseparabili. Li riconosco: sulla sinistra il sodio (Na), sulla destra il cloro (Cl). Il sodio all’undicesimo posto della tavola periodica degli elementi è composto di un nucleo di 11 protoni 12 neutroni ed 11 elettroni. I neutroni sono particelle del tutto simili ai protoni ma privi di carica elettrica e contribuiscono a tenere unito il nucleo. Come vi ho già detto, i protoni hanno una carica positiva, odiano i loro simili, tanto che a contatto diretto si respingono brutalmente (bruttissimo carattere).
I neutroni sono, invece dei “paciocconi”, si insinuano tra due protoni ed evitano qualsiasi contatto pericoloso tra i due, contribuendo alla stabilità del nucleo. Intorno, a distanze siderali, ruotano 11 elettroni, a formare l’atomo di sodio, che in realtà, non esiste libero in natura: un elettrone, degli undici teorici, si perde continuamente e rimane lo ione di sodio: Na+.
Gli ioni, quindi, sono atomi in deficit di un elettrone (cationi) di carica positiva (quella del protone nucleare che manca dell’elettrone antagonista). Gli anioni sono sempre ioni ma con un elettrone in eccesso e di carica negativa. Sentendosi insoddisfatti (instabili), gli ioni sono sempre alla ricerca di un partner con cui “legare” e scambiarsi elettroni.
Lo ione del cloro con un elettrone di troppo è un anione, elettricamente negativo: Cl–.
Quest’ultimo si intende a meraviglia con Na+.
In definitiva, si capisce, a prima vista, che Na+ e Cl– sono fatti l’uno per l’altra. Il loro matrimonio è il tipico legame ionico che forma una molecola, vera star, della tavola degli elementi: NaCl, il sale da cucina, molecola che troviamo in abbondanza in natura.
L’acqua (H2O) invece è l’esempio di un tipico legame covalente. L’idrogeno lo abbiamo esplorato: 1 protone ed un elettrone. C’è solo una precisazione da fare: quello che abbiamo conosciuto è solo uno dei tre isotopi dell’idrogeno: il prozio (1H).
Gli altri due sono:
- il deuterio (2H) composta da: un protone ed un neutrone nel nucleo ed un elettrone in orbita.
- Il trizio (3H): 1 protone, 2 neutroni nel nucleo ed il solito elettrone. Scusate, mi sono scordato di dirvi cos’è un isotopo: un isotopo, in breve, è un atomo più o meno grasso: i protoni e gli elettroni sono sempre gli stessi, ciò che muta è il nucleo a contenere più o meno neutroni. Questo cambia il peso atomico, ma non influenza l’equilibrio elettrico.
Veniamo all’ossigeno: L’ossigeno ha 8 protoni nel nucleo e 8 elettroni sulle orbite. E neutroni? Anche in questo caso ci sono degli isotopi di cui non parliamo e consideriamo solo il più comune con 8 neutroni (stesso dei protoni).
L’ossigeno sarebbe di per sé un atomo “felice”; protoni, neutroni ed elettroni sono in numero pari e la carica elettrica si bilancia perfettamente. Tutto filerebbe liscio se non fosse per i due elettroni (i coccolini di famiglia) in cerca di amici. L’idrogeno è il partner perfetto, gli elettroni esterni dell’ossigeno condivideranno le orbite con quelle di due atomi di idrogeno a stringere un legame chimico covalente. Da questo connubio perfetto prendono vita le molecole della vita (scusate il bisticcio): l’acqua!
Ora, sorseggiando un bicchiere della nostra ottima acqua di montagna, vi saluto in attesa di continuare questo viaggio meraviglioso.






